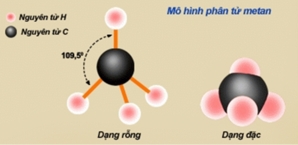
* Nhận xét:
Bạn đang đọc: TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA ANKAN
– Cấu tạo của ankan chỉ có link σ vững chắc → Ankan tương đối trơ về mặt hóa học : Ở nhiệt độ thường chúng không phản ứng với axit, bazơ và chất oxi hóa mạnh ( như KMnO4 ). Vì thế ankan còn có tên là parafin, nghĩa là ít ái lực hóa học .
III. TÍNH CHẤT HOÁ HỌC
– Dưới tác dụng của ánh sáng, xúc tác và nhiệt, ankan tham gia các phản ứng thế, phản ứng tách và phản ứng oxi hóa.
1. Phản ứng thế
a. Metan công dụng với clo / ánh sáng
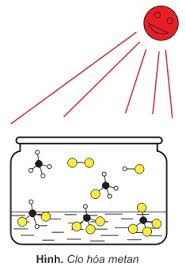
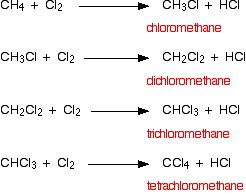
* Nhận xét:
– Về nguyên tắc các nguyên tử H trong phân tử ankan có thể bị thay thế lần lượt từ 1 đến hết.
b. Đồng đẳng của metan
– Propan tính năng với clo ( as, tỉ lệ 1 : 1 )
CH3-CH2-CH3 + Cl2 → CH3-CH2-CH2Cl + HCl
43 %
→ CH3-CHCl-CH3 + HCl
57 %
– Propan tính năng với brom ( t0, tỉ lệ 1 : 1 )
CH3-CH2-CH3 + Br2 → CH3-CH2-CH2Br + HBr
3 %
→ CH3-CHBr-CH3 + HBr
97 %
* Nhận xét:
– Khả năng phản ứng : Cl2 > Br2 > I2 và Cbậc 3 > Cbậc 2 > Cbậc 1. Sản phẩm chính là loại sản phẩm ưu tiên thế X vào H của C bậc cao ( C có ít H hơn ). C bậc a là C link với a nguyên tử C khác .
– Phản ứng thế xảy ra theo chính sách gốc tự do
– dây chuyền sản xuất gồm 3 tiến trình :
+ Khơi mào phản ứng :
X2 → 2X .
+ Phát triển mạch :
X. + CnH2n + 2 → CnH2n + 1. + HX
CnH2n + 1. + X2 → CnH2n + 1X + X .
+ Tắt mạch :
2X. → X2
X. + CnH2n + 1. → CnH2n + 1X
CnH2n + 1. + CnH2n + 1. → C2nH4n + 2
2. Phản ứng xảy ra do tác dụng của nhiệt
a. Phản ứng tách H2 (phản ứng đề hiđro hóa)
CH3-CH2-CH3 → CH2 = CH-CH3 + H2
Tổng quát
CnH2n + 2 → CnH2n + H2 ( Fe, t0 )
Anken
* Lưu ý:
– Chỉ những ankan trong phân tử có từ 2 nguyên tử C trở lên mới có năng lực tham gia phản ứng tách H2 .
– Trong phản ứng tách H2, 2 nguyên tử H gắn với 2 nguyên tử C nằm cạnh nhau tách ra cùng nhau và ưu tiên tách H ở C bậc cao .
CH3-CH ( CH3 ) – CH2-CH3 → CH2 = C ( CH3 ) – CH2-CH3 + H2
loại sản phẩm phụ
→ CH3-C ( CH3 ) = CH-CH3 + H2
loại sản phẩm chính
– Một số trường hợp riêng khác :
CH3-CH2-CH2-CH3 → 2H2 + CH2=CH-CH=CH2
CH3-CH ( CH3 ) – CH2-CH3 → CH2 = C ( CH3 ) – CH = CH2 + 2H2
n-C6H14 → 4H2 + C6H6 ( benzen )
n-C7H16 → 4H2 + C6H5CH3 ( toluen )
b. Phản ứng phân hủy
– Phản ứng phân hủy bởi nhiệt :
CH4 → C + 2H2 ( t0 )
c. Phản ứng crăcking (n≥ 3)
C4H10 → CH4 + C3H6
→ C2H4 + C2H6
Tổng quát
CnH2n + 2 → CxH2x + 2 + CyH2y ( t0, p, xt )
* Lưu ý:
+ Ankan thẳng CnH2n + 2 khi crăcking hoàn toàn có thể xảy ra theo ( n – 2 ) hướng khác nhau tạo ra 2 ( n-2 ) mẫu sản phẩm .
+ Nếu hiệu suất phản ứng crăcking là 100 % và không có quy trình cracking thứ cấp thì tổng số mol loại sản phẩm tăng gấp đôi so với những chất tham gia nên KLPTTB giảm đi 50% .
+ Số mol ankan sau phản ứng luôn bằng số mol ankan bắt đầu dù quy trình cracking có nhiều tiến trình .
3. Phản ứng cháy
CnH2n + 2 + ( 3 n + 1 ) / 2O2 → nCO2 + ( n + 1 ) H2O
– Đối với phản ứng cháy của ankan cần quan tâm 2 đặc thù :
+ nCO2 < nH2O .
+ nH2O - nCO2 = nankan bị đốt cháy .
- Nếu đốt cháy 1 hiđrocacbon mà thu được nCO2 < nH2O thì hiđrocacbon đem đốt cháy thuộc loại ankan .
- Nếu đốt cháy hỗn hợp hiđrocacbon cho nCO2 < nH2O thì trong hỗn hợp đốt cháy có chứa tối thiểu 1 ankan .
* Lưu ý: Nếu ankan oxi hóa không hoàn toàn và có xúc tác thích hợp sẽ tạo ra sản phẩm hữu cơ như andehit, axit cacboxylic…
Ví dụ : CH4 + O2 → HCHO + H2O
IV. ĐIỀU CHẾ
– Nhiệt phân muối Natri của axit cacboxylic ( phản ứng vôi tôi xút ) :
CH3COONa + NaOH → CH4 + Na2CO3
Tổng quát :
CnH2n + 2 – x ( COONa ) x + xNaOH → CnH2n + 2 + xNa2CO3 ( CaO, t0 )
– Cộng hiđro vào hiđrocacbon không no hoặc vòng không bền :
CnH2n + 2-2 k + kH2 → C nH2n + 2 ( Ni, t0 )
– Riêng với CH4 hoàn toàn có thể dùng phản ứng :
Al4C3 + 12H2 O → 4A l ( OH ) 3 + 3CH4
Al4C3 + 12HC l → 4A lCl3 + 3CH4
C + 2H2 → CH4 ( xúc tác, t0 )
– Tách từ nguồn khí thiên nhiên .
V. ỨNG DỤNG
– Dùng làm nguyên vật liệu ( CH4 dùng trong đèn xì để hàn, cắt sắt kẽm kim loại ) .
– Dùng làm dầu bôi trơn .
– Dùng làm dung môi .
– Để tổng hợp nhiều chất hữu cơ khác : CH3Cl, CH2Cl2, CCl4, CF2Cl2, …
– Đặc biệt từ CH4 điều chế được nhiều chất khác nhau : hỗn hợp CO + H2, amoniac, CH ≡ CH, rượu metylic, anđehit fomic
Trung tâm luyện thi, gia sư – dạy kèm tại nhà NTIC Đà Nẵng
LIÊN HỆ NGAY VỚI CHÚNG TÔI ĐỂ BIẾT THÊM THÔNG TIN CHI TIẾT
ĐÀO TẠO NTIC
Địa chỉ: Đường nguyễn lương bằng, P.Hoà Khánh Bắc, Q.Liêu Chiểu, Tp.Đà Nẵng
Hotline: 0905540067 – 0778494857
Email: daotaontic@gmail.com
Source: https://mindovermetal.org
Category: Ứng dụng hay









