Định luật Lambert-Beer, hay Beer-Lambert, Beer–Lambert–Bouguer, là một định luật có nhiều ứng dụng trong hoá học và vật lý. Định luật này được dựa trên hiện tượng hấp thụ bức xạ điện từ của một dung dịch. Định luật này được sử dụng nhiều trong hoá phân tích hữu cơ và vật lý quang học. Định luật này được tìm ra lần đầu bởi nhà khoa học người Pháp Pierre Bouguer, tuy nhiên những đóng góp quan trọng lại thuộc về Johann Heinrich Lambert và August Beer.
Mục lục nội dung
Độ truyền quang và độ hấp thụ[sửa|sửa mã nguồn]
Độ truyền quang[sửa|sửa mã nguồn]
Độ truyền quang (T) là tỉ lệ giữa lượng ánh sáng đi qua một mẫu (P) so với lượng ánh sáng ban đầu được chiếu vào mẫu (ánh sáng tới, Pₒ)
- Độ truyền quang T { \ displaystyle T }
P
P
o{\displaystyle {\frac {P}{Po}}}
Bạn đang đọc: Định luật Beer–Lambert – Wikipedia tiếng Việt
 Chiếu một chùm tia tới có cường độ Pₒ đi qua 1 dung dịch có màu, trong suốt, thu được chùm tia ló có cường độ P. luôn thoả mãn P.
Chiếu một chùm tia tới có cường độ Pₒ đi qua 1 dung dịch có màu, trong suốt, thu được chùm tia ló có cường độ P. luôn thoả mãn P.
Độ hấp thụ[sửa|sửa mã nguồn]
Độ hấp thụ (A) của một mẫu được định nghĩa là số đối của logarit của độ truyền qua.
Độ hấp thụ
A
=
−
log
T
=
−
log
P
P
o
{\displaystyle A=-\log T=-\log {\frac {P}{Po}}}
Nội dung định luật[sửa|sửa mã nguồn]
Mối quan hệ giữa độ hấp thụ và độ dày truyền ánh sáng[sửa|sửa mã nguồn]
Năm 1760, trong cuốn Photometria[1], Lambert đã trích dẫn một số nội dung từ cuốn Essai d’optique sur la gradation de la lumière[2] của Pierre Bouguer, nêu lên rằng độ hấp thụ quang tỉ lệ thuận với độ dày truyền ánh sáng (ℓ):
A
∝
ℓ
{\displaystyle A\propto \ell }
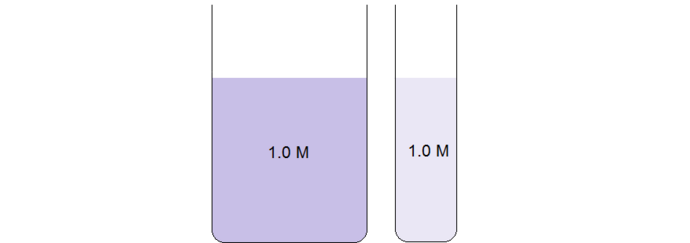 2 ống nghiệm chứa cùng một chất, có nồng độ bằng nhau. Tuy nhiên, ta nhìn thấy màu ở ồng nghiệm lớn hơn đậm hơn là do tại đường kính ống nghiệm này lớn dẫn đến độ dày truyền ánh sáng lớn nên ánh sáng vàng bị dung dịch hấp thụ nhiều hơn, màu tím của dung dịch lại càng được biểu lộ ra điển hình nổi bật hơn. ( Dung dịch có màu tím do ánh sáng vàng là màu bổ trợ với tím bị hấp thụ, khi 2 màu này đi với nhau thì chúng triệt tiêu nhau, còn nếu một màu bị hấp thụ thì màu kia sẽ phản xạ lại mắt ta tạo thành màu của vật thể .
2 ống nghiệm chứa cùng một chất, có nồng độ bằng nhau. Tuy nhiên, ta nhìn thấy màu ở ồng nghiệm lớn hơn đậm hơn là do tại đường kính ống nghiệm này lớn dẫn đến độ dày truyền ánh sáng lớn nên ánh sáng vàng bị dung dịch hấp thụ nhiều hơn, màu tím của dung dịch lại càng được biểu lộ ra điển hình nổi bật hơn. ( Dung dịch có màu tím do ánh sáng vàng là màu bổ trợ với tím bị hấp thụ, khi 2 màu này đi với nhau thì chúng triệt tiêu nhau, còn nếu một màu bị hấp thụ thì màu kia sẽ phản xạ lại mắt ta tạo thành màu của vật thể .
Mối quan hệ giữa độ hấp thụ và nồng độ mẫu dung dịch[sửa|sửa mã nguồn]
Năm 1852, gần 100 năm sau nghiên cứu của J.H Lambert, August Beer mới tìm ra một mối quan hệ nữa để hoàn thiện định luật. Ông nhận ra rằng độ hấp thụ của một mẫu thì tỉ lệ thuận với nồng độ (c) của chất chứa trong mẫu đó:
A
∝
c
{\displaystyle A\propto c}
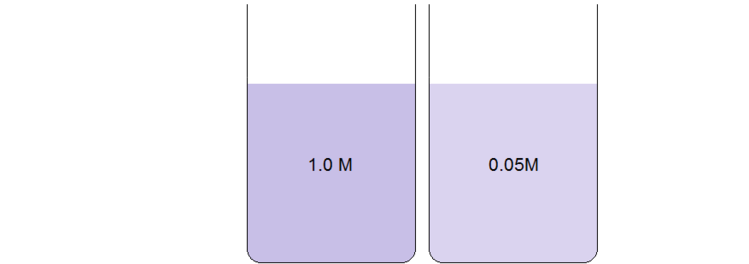 Ống nghiệm có nồng độ thấp hơn có màu nhạt hơn do độ hấp thụ nhỏ hơn
Ống nghiệm có nồng độ thấp hơn có màu nhạt hơn do độ hấp thụ nhỏ hơn
Phát biểu định luật[sửa|sửa mã nguồn]
Kết hợp khu công trình của J.H.Lambert và A.Beer, ta có phương trình Beer-Lambert, được phát biểu như sau :
Độ hấp thụ quang của một dung dịch đối với một chùm sáng đơn sắc tỉ lệ thuận với độ dày truyền quang và nồng độ chất tan trong dung dịch.
hay
A
∝
ℓ
×
c
{\displaystyle A\propto \ell \times c}
A
=
ϵ
×
ℓ
×
c
{\displaystyle A=\epsilon \times \ell \times c}

trong đó :
A
{\displaystyle A}

ℓ
{\displaystyle \ell }

Xem thêm: Ứng dụng của tích phân tính diện tích, thể tích, quãng đường, vận tốc cực hay – Toán lớp 12
c
{\displaystyle c}

ϵ
{\displaystyle \epsilon }

- Định luật này không nên áp dụng cho các mẫu dung dịch có nồng độ quá cao, do nồng độ càng cao thì ảnh hưởng ủa các yếu tố khác càng lớn, gây ra các sai số đáng kể.
- Khi đo độ hấp thụ quang, sử dụng dữ liệu của bước sóng bị hấp thụ nhiều nhất để tăng độ chính xác.
Kotz / Treichel / Townsend / Treichel’s ‘ ‘ Chemistry and Chemical Reactivity ‘ ‘ 9 e., ISBN1-285-46253-X
Source: https://mindovermetal.org
Category: Ứng dụng hay