Mục lục nội dung
Xem toàn bộ tài liệu Lớp 11: tại đây
Giải Bài Tập Hóa Học 11 – Bài 5 : Luyện tập : Axit, bazơ và muối. Phản ứng trao đổi ion trong dung dịch các chất điện li giúp HS giải bài tập, phân phối cho các em một mạng lưới hệ thống kiến thức và kỹ năng và hình thành thói quen học tập thao tác khoa học, làm nền tảng cho việc tăng trưởng năng lượng nhận thức, năng lượng hành vi :
Bài 1 (trang 22 SGK Hóa 11): Viết phương trình điện li của các chất sau: K2S, Na2HPO4, NaH2PO4, Pb(OH)2, HBrO, HF, HClO4.
Lời giải:
Bạn đang đọc: Bài 5: Luyện tập: Axit, bazơ và muối. Phản ứng trao đổi ion trong dung dịch các chất điện li
a. K2S → 2K + + S2 –
b. Na2HPO4 → 2N a + + HPO42 –
HPO42 – ⇆ H + + PO43 –
c. NaH2PO4 → Na + + H2PO4 –
H2PO4 – ⇆ H + + HPO42 –
HPO42 – ⇆ H + + PO43 –
d. Pb ( OH ) 2 ⇆ Pb2 + + 2OH –
Hoặc H2PbO2 ⇆ 2H + + PbO22 –
e. HBrO ⇆ H + + BrO –
g. HF ⇆ H + + F –
h. HClO4 ⇆ H + + ClO4 –
Bài 2 (trang 22 SGK Hóa 11): Một dung dịch có [H+] = 0,010 M. Tính [OH–] và pH của dung dịch. Môi trường của dung dịch này là axit, trung tính hay kiềm? Hãy cho biết màu của quỳ trong dung dịch này?
Lời giải:
[ H + ] = 0,010 M = 10-2 M ⇒ pH = – log [ H + ] = – log ( 1,0. 10-2 ) = 2
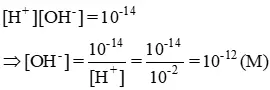
Môi trường của dung dịch này là axit ( pH < 7 ) Cho quỳ tím vào dung dịch này quỳ sẽ chuyển thành màu đỏ
Bài 3 (trang 22 SGK Hóa 11): Một dung dịch có pH = 9,0. Tính nồng độ mol của H+ và OH– trong dung dịch? Hãy cho biết màu của phenolphtalein trong dung dịch này?
Lời giải:
pH = 9,0 ≥ [H+] = 10-9 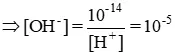
Cho phenolphtalein trong dung dịch này sẽ thấy phenolphtalein chuyển thành màu hồng ( khi pH ≥ 8,3 phenolphtalein đổi màu )
Bài 4 (trang 22 SGK Hóa 11): Viết phương trình phân tử và ion rút gọn của các phản ứng (nếu có) xảy ra trong dung dịch các cặp chất sau:
a. Na2CO3 + Ca ( NO3 ) 2
b. FeSO4 + NaOH ( loãng )
c. NaHCO3 + HCl
d. NaHCO3 + NaOH
e. K2CO3 + NaCl
g. Pb ( OH ) 2 ( r ) + HNO3
h. Pb ( OH ) 2 ( r ) + NaOH
i. CuSO4 + Na2S
Lời giải:
a. Na2CO3 + Ca ( NO3 ) 2 → 2N aNO3 + CaCO3
Ca2 + + CO32 – → CaCO3 ↓
b. FeSO4 + 2N aOH ( loãng ) → Fe ( OH ) 2 ↓ + Na2SO4
Fe2+ + 2OH– → Fe(OH)2↓
c. NaHCO3 + HCl → NaCl + H2O + CO2 ↑
H + + HCO3 – → H2O + CO2 ↑
d. NaHCO3 + NaOH → Na2CO3 + H2O
HCO3 – + OH – → CO32 – + H2O
e. K2CO3 + NaCl Không có phản ứng
g. Pb ( OH ) 2 ( r ) + 2HNO3 → Pb ( NO3 ) 2 + 2H2 O
Pb ( OH ) 2 ( r ) + 2H + Pb2 + + 2H2 O
h. Pb ( OH ) 2 ( r ) + 2N aOH → Na2PbO2 + 2H2 O
Pb ( OH ) 2 ( r ) + 2OH – → PbO22 – + 2H2 O
i. CuSO4 + Na2S → CuS + Na2SO4
Cu2 + + S2 – → CuS
Bài 5 (trang 23 SGK Hóa 11): Phản ứng trao đổi ion trong dung dịch chất điện li chỉ xảy ra khi:
A. Các chất phản ứng phải là những chất dễ tan .
B. Các chất phản ứng phải là những chất điện li mạnh .
C. Một số ion trong dung dịch phối hợp được với nhau làm giảm nồng độ ion của chúng .
D. Phản ứng không phải là thuận nghịch .
Hãy chọn câu vấn đáp đúng .
Lời giải:
Đáp án C
Bài 6 (trang 23 SGK Hóa 11): Kết tủa CdS được tạo thành bằng dung dịch các cặp chất nào dưới đây:
A. CdCl2 + NaOH
B. Cd ( NO3 ) 2 + H2S
C. Cd ( NO3 ) 2 + HCl
D. CdCl2 + Na2SO4
Lời giải:
– Đáp án B
Cd ( NO3 ) 2 + H2S → CdS ↓ + 2HNO3
Bài 7 (trang 23 SGK Hóa 11): Viết phương trình hoá học (dưới dạng phân tử và ion rút gọn) của phản ứng trao đổi ion trong dung dịch tạo thành từng chất kết tủa sau:Cr(OH)3 ; Al(OH)3; Ni(OH)2
Lời giải:
CrCl3 + 3N aOH ( đủ ) → Cr ( OH ) 3 ↓ + 3 NaCl
Cr3 + + 3OH – → Cr ( OH ) 3 ↓
AlCl3 + 3N aOH ( đủ ) Al ( OH ) 3 ↓ + 3 NaCl
Al3 + + 3OH – → Al ( OH ) 3 ↓
Hoặc AlCl3 + 3NH3 ( dư ) + 3H2 O → Al ( OH ) 3 ↓ + 3NH4 Cl
Al3+ + 3NH3 (dư) + 3H2O → Al(OH)3 ↓ + 3NH4+
Ni ( NO3 ) 2 + 2N aOH → Ni ( OH ) 2 ↓ + 2N aNO3
Ni2 + + 2OH – → Ni ( OH ) 2 ↓
Source: https://mindovermetal.org
Category: Ứng dụng hay









